Proteinstruktur
I mennesker og i naturen er alle aminosyrer i L-form (stereoisomer). Vi skiller aminosyrer alltid ved R-gruppen (sidegruppen). Aminosyrer og proteiner kan virke som buffere rundt deres respektive pKa-verdier. Histadin har en pKa-verdi ~6 (nær nøytral pH).
Hvor bindes aminosyrene sammen?
I ribosomene. Reaksjonen minker kaoset i systemet (entropien) betydelig. Aminosyrene går fra å flyte fritt i cytosol til å bli satt sammen i en spesifikk sekvens. Vi trenger energi og enzymer for at reaksjonen skal gå.
Enzymer katalyserer andre enzymer er ikke proteiner. Vi har tre enzymer i kroppen som er RNA-enzymer (trolig rester fra tidligere evolusjonær historie).
Peptidbindingen er en resonnerende “1.5”, delvis dobbeltbinding. Dette begrenser bevegeligheten til bindingen (derfor rett). Reaksjonen er en kondensasjonsreaksjon som spalter av et H2O-molekyl.
Naturens prinsipp: maksimering av stabilitet.
Proteiner kan denatureres av bl.a. temperatur, pH, og saltkonsentrasjon. Proteinets egenskaper er avhengig av foldningen. Små dipolkrefter samles i en slags “borrelåseffekt”: Van der Waal, hydrogenbindinger, polare samhandlinger, (disulfidbindinger, kovalente) usw.
- Primærstruktur
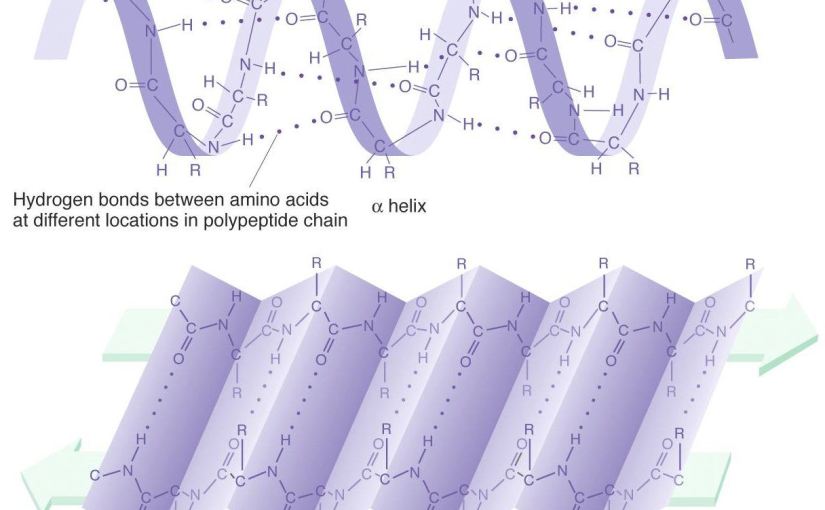
Aminosyrenes rekkefølge - Sekundærstruktur
Alfaheliks, betaflak
Hydrogenbindinger inni, hydrogenbindinger mellom - Tertiærstrukturen
Komplekser av sekundærstrukturen - Kvartærstrukturen
Flere polypeptider samler seg og danner multimerte proteiner
Sigdcelleanemi skyldes mutasjon i en aminosyre i hemoglobin (små forskjeller, store virkninger).
Foreleser: Sandip Kanse
Ressurser
Presentasjon