Ikke alle enzymer er proteiner; noen er RNA.
Hvorfor RNA?
Fordi RNA er en enkel kjede som kan folde og danne bindinger (basepar) med “seg selv” (egne baser).
Enzymer er involvert i alt. De funker ved at substrater fester seg til spesielle områder på enzymet (v/ svake krefter, hydrogenbindinger) og danner et enzym-substrat-kompleks. Denne prosessen 1) senker aktiviseringsenergien for reaksjonen mellom substrater og 2) øker sannsynlighet for at substrater møter hverandre. Enzymer er svært selektive.
- Lås-og-nøkkelmodell (lock and key model)
Gammel modell

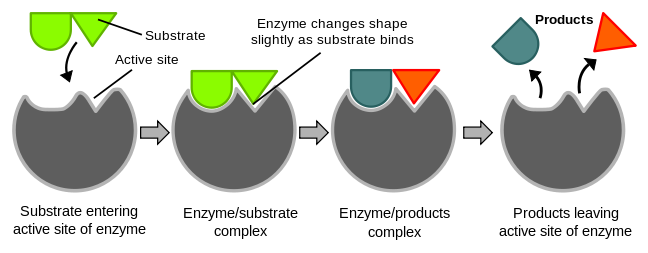
- Indusert-tilpasningsmodell (induced fit model)
Ny modell
Enzymer trenger koenzymer og kofaktorer (vanskelig å skille, selv foreleser er usikker) for funksjonen. De kan enten være bundet løst: koenzym, kofaktor, eller sterkt: prostetisk gruppe.
- Et inaktivt enzym uten kofaktor kalles et apoenzym
- Et aktivt enzym med kofaktor kalles et holoenzym
Koenzymer er kofaktorer som endres i løpet av en reaksjon (e.g. NADPH, NADH, ATP). De er som substrater.
Enzymer er tilpasset omgivelsene sine (optimumstemperatur: fysiologisk 37, pH usw.). Hvordan overlever noen bakterier i 100 grader celsius? Mutasjoner i enzymene (e.g. aminosyrer) som motvirker de ekstreme forholdene,
Masseproduksjon av enzymer er en revolusjon. I vaskepulver er det mye av enzymet protease (fordi det er protein i mat). Det er derfor du ikke bør bruke det til å vaske ull (eller e.g. silke) fordi ull består av proteiner.
Hva er den viktigste evolusjonære fordelen ved å ha magesyre?
Å drepe organiske organismer, uskaddeliggjøre fremmede agenser. I magesyren finner vi enzymer med lavere optimumspH (e.g. pepsin).
Glukokinase er et enzym som katalyserer reaksjonen fra glukose til glukose-6-fosfat. Vi finner det hovedsakelig i leveren, hypothalamus, og betacellene i bukspyttkjertelen. Heksokinase er et høyaffinitetsenzym (lav Km, Michaeliskonstant). Glukokinase er et lavaffinitetsenzym.
Jo høyere affinitet et enzym har til substratet, jo sterkere binding og kjappere reaksjon (bedre katalysator).
Foreleser: Sandip Kanse
Ressurser
Presentasjon



